Resumen
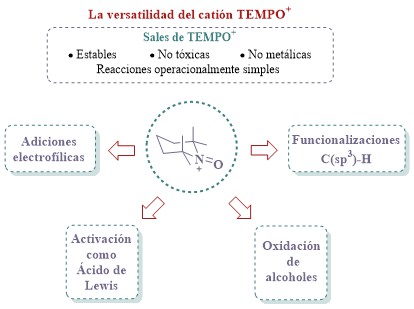
El catión tetrametilpiperidina-N-oxoamonio (TEMPO+) y derivados, han encontrado diversas aplicaciones en síntesis orgánica, principalmente como oxidante de alcoholes. Sin embargo, el TEMPO+ también ha resultado ser un reactivo eficiente y selectivo para la funcionalización C(sp3)–H de N-heterociclos, y recientemente se descubrió que actúa como ácido de Lewis en reacciones de adición electrofílica, ordenamiento de Nazarov y arreglo de Ferrier. Debido a su naturaleza no metálica, alta estabilidad y baja toxicidad, las sales de TEMPO+ se consideran reactivos “verdes”. Por tanto, en este artículo exploraremos brevemente la evolución de la química del TEMPO+ y su aplicación en diversas transformaciones químicas. Mostraremos ejemplos representativos y describiremos sus mecanismos de reacción para resaltar el privilegiado papel que el TEMPO+ juega en síntesis orgánica.
Referencias
V. A. Golubev, É. G. Rozantsev, M. B. Neiman, Izv. Akad. Nauk SSSR, Ser. Khim. 1965, 11, 1927 (Bull. Acad. Sci. USSR, Chem. Sci. 1965, 14,1898–1904). https://doi.org/10.1007/BF00845878.
A. E. J. de Nooy, A. C. Besemer, H. van Bekkum, Synthesis, 1996, 10, 1153-1176. https://doi.org/10.1055/s-1996-4369.
J. M. Bobbitt, C. Brückner, N. Merbouh, Org. React. 2009, 74, 103–424. https://doi.org/10.1002/0471264180.or074.02.
Nitroxide‐catalyzed alcohol oxidations in organic synthesis. Stable Radicals. C. Brückner, Wiley, July 16, 2010, pp 433–460. https://doi.org/10.1002/9780470666975.ch12.
S. Cruz-Gregorio, J. Romero-Ibañez, F. Sartillo-Piscil, Targets Heterocycl. Syst. 2022, 26, 100–121. https://doi.org/10.17374/targets.2023.26.100
L. Porras-Santos, J. Sandoval-Lira, L. Quintero, J. M. Hernández-Pérez, P. López-Mendoza, F. Sartillo-Piscil, J. Org. Chem. 2024, 89, 11281–11292. https://doi.org/10.1021/acs.joc.4c00978.
J. Bautista-Nava, L. Porras-Santos, A. Pérez-Bautista, L. Quintero, P. López-Mendoza, F. Sartillo-Piscil, J. Org. Chem. 2025, 90, 6251–6260. https://doi.org/10.1021/acs.joc.5c00354.
V. A. Golubev, V. N. Borislavskii, A. L. Aleksandrov, Russ. Chem. Bull. 1977, 9, 1874–1881. (Traducido al Inglés). https://doi.org/10.1007/BF00924380.
M.F. Semmelhack, C.R. Schmid, D.A Cortés, Tetrahedron Lett. 1986, 27, 1119–1122. https://doi.org/10.1016/S0040-4039(00)84193-3.
W. F. Bailey, J. M. Bobbitt, K.B. Wiberg, J. Org. Chem. 2007, 72, 4504−4509. https://doi.org/10.1021/jo0704614.
J. M. Bobbitt, A. L. Bartelson, W. F. Bailey, T. A. Hamlin, C. B. Kelly, C. B., J. Org. Chem. 2014, 79, 1055–1067. https://doi.org/10.1021/jo402519m.
T. A Hamlin, C. B. Kelly, J. M. Ovian, R. J. Wiles, L. J. Tilley, N. E. Leadbeater, J. Org. Chem. 2015, 80, 8150–8167. https://doi.org/10.1021/acs.joc.5b01240.
H. Richter, O. García-Mancheño, Eur. J. Org. Chem. 2010, 23, 4460–4467. https://doi.org/10.1002/ejoc.201000548.
Y. Changcun, L. Yuxiu, W. Qingmin, Org. Lett. 2015, 17, 5714–5717. https://doi.org/10.1021/acs.orglett.5b03042.
U. Osorio-Nieto, D. Chamorro-Arenas, L. Quintero, H. Höpfl, F. Sartillo-Piscil, J. Org. Chem. 2016, 81, 8625−8632. https://doi.org/10.1021/acs.joc.6b01566.
J. Romero-Ibañez, S. Cruz-Gregorio, J. Sandoval-Lira, J. M. Hernández-Párez, L. Quintero, F. Sartillo-Piscil, F. Angew.Chem. Int. Ed. 2019, 58, 8867−8871. https://doi.org/10.1002/anie.201903880.
A. Recoba-Torres, S. Cruz-Gregorio, L. Quintero, J. Sandoval-Lira, J. Romero-Ibañez, F. Sartillo-Piscil. Eur. J. Org. Chem. 2022, e202200292. https://doi.org/10.1002/ejoc.202200292.
Á. A. Nolasco-Hernández, L. Quintero, S. Cruz-Gregorio, F. Sartillo-Piscil, J. Org. Chem. 2024, 89, 1762–1768. https://doi.org/10.1021/acs.joc.3c02466.
J. Rivera-Mendoza, Á. A. Nolasco-Hernández, L. Quintero, V. Carranza-Téllez, F. Sartillo-Piscil, Tetrahedron 2025, 185, 134800. https://doi.org/10.1016/j.tet.2025.134800.
Y. He, Q. Liu, T. Gong, Y. Liu, X. Zhang, X. Fan, Org. Chem. Front. 2023, 10, 1206–1212. https://doi.org/10.1039/D2QO01427K.
S. Masatoshi, T. Masaki, Y. Iwabuchi, J. Org. Chem. 2008, 73, 4750–4752, https://doi.org/10.1021/jo800634r.
Y. Zhang, Y. Chen, M. Song, B. Tan, Y. Jiang, C. Yan, Y. Jiang, X. Hu, C. Zhang, W. Chen, J. Xu, J. Am. Chem. Soc. 2022, 144, 16042−16051. https://doi.org/10.1021/jacs.2c05957.
K. Moriyama, M. Kuramochi, S.Tsuzuki, K. Fujii, T. Morita, Org. Lett. 2021, 23, 268−273. https://doi.org/10.1021/acs.orglett.0c03546.

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
Derechos de autor 2025 Anales de Química de la RSEQ